Persamaan pada Gas Ideal (Hukum Boyle – Gay Lussac)
Seperti yang sudah dijelaskan pada postingan sebelumnya bahwa jika suatu zat dipanaskan atau diberikan kalor maka zat tersebut akan memuai. Untuk zat padat akan terjadi pemuaian pajang, pemuaian luas, dan pemuaian volume. Sedangkan untuk zat cair hanya terjadi pemuaian volume, kecuali air pada suhu 0°C jika dipanaskan hingga suhunya mencapai 4°C justru mengalami penyusutan, yang dikenal dengan peritiwa anomali air. Untuk zat yang berbentuk gas, tidak hanya terjadi pemuaian volume juga bisa mengalami pemuaian tekanan jika suhunya dinaikan.
Untuk pemuaian pada gas akan ada tiga perlakuan yang berbeda yakni sebagai berikut: 1) pemuaian volume gas pada tekanan tetap yang ditemukan oleh seorang ilmuwan dari Prancis yang bernama Jacques Charles, sehingga hasil penemuannya dikenal dengan Hukum Charles; 2) pemuaian tekanan gas pada volume tetap yang ditemukan oleh Joseph Gay Lussac yang dikenal dengan Hukum Gay Lussac; dan 3) pemuaian volume gas pada suhu tetap yang ditemukan oleh Robert Boyle (1627 - 1691) atau yang dikenal dengan Hukum Boyle.
Nah dari ketiga hukum-hukum (Charles, Gay Lussac, dan Boyle) tersebut dapat digabungkan menjadi satu hubungan yang lebih umum antara tekanan, volume, dan suhu dari gas dengan jumlah tertentu. Adapun hubungan ketiga besaran tersebut ditulis dengan hubungan sebagai berikut:
PV ≈ T
Hubungan ini menunjukkan bahwa besaran P, V, atau T akan berubah ketika yang lainnya diubah. Percobaan yang teliti menunjukkan bahwa pada suhu dan tekanan konstan, volume V dari sejumlah gas di tempat tertutup berbanding lurus dengan massa m dari gas tersebut, yang dapat dituliskan:
PV ≈ mT.
Perbandingan ini dapat dibuat menjadi persamaan dengan memasukkan konstanta perbandingan. Penelitian menunjukkan bahwa konstanta ini memiliki nilai yang berbeda untuk gas yang berbeda. Akan tetapi, konstanta pembanding tersebut ternyata memiliki nilai yang sama sama untuk semua gas, jika kita menggunakan angka mol. Pada umumnya, jumlah mol (n) pada suatu sampel zat murni tertentu sama dengan massanya dalam gram dibagi dengan massa molekul yang dinyatakan sebagai gram per mol. Persamaan untuk mol yakni:
n = m/Mr
dengan:
n = jumlah mol (mol)
m = massa (gr)
Mr = massa molekul relatif (gr/mol)
Sehingga perbandingan tersebut dapat dituliskan sebagai suatu persamaan sebagai berikut:
Dengan, n menyatakan jumlah mol dan R adalah konstanta pembanding. R disebut konstanta gas umum karena nilainya secara eksperimen ternyata sama untuk semua gas. Nilai R, pada beberapa satuan adalah sebagai berikut:
R = 8,315 J/(mol.K)
R = 0,0821 (L.atm)/(mol.K)
R = 1,99 kalori/(mol.K)
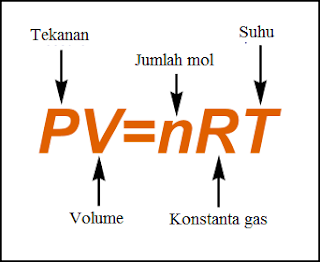
Persamaan PV = n.R.T disebut Hukum Gas Ideal atau dikenal dengan hukum Boyle -Gay Lussac. Istilah “ideal” digunakan karena gas riil (nyata) tidak mengikuti persamaan tersebut. Jadi, pada proses pemuaian gas terjadi dengan tekanan berubah, volum berubah dan suhu berubah maka dapat diselesaikan dengan persamaan:
PV = nRT
PV/T = nR
Karena nilai nR tetap untuk gas yang sama, maka:
PV/T = konstan
atau
P1 .V1/T1= P2 .V2 /T2
P1 .V1/T1= P2 .V2 /T2
dengan:
P1 = tekanan gas awal (Pa)
P2 = tekanan gas akhir (Pa)
V1 = volume gas awal (m3)
V2 = volume gas akhir (m3)
T1 = suhu mutlak gas awal (K)
T2 = suhu mutlak gas akhir (K)
Untuk memantapkan pemahaman Anda tentang pemuaian volume gas pada gas ideal atau hukum Boyle - Gay Lussac, silahkan simak dan pahami contoh soal di bawah ini.
Contoh Soal
Gas dengan volume 7 liter pada suhu 27°C dan tekanan 2 atm dimampatkan hingga tekanannya mencapai 6 atm pada suhu 42°C. Hitunglah volume gas sekarang!
Penyelesaian:
Diketahui:
V1 = 7L
T1 = 27°C = 300K
P1 = 2 atm
T2 = 42°C = 315K
P2 = 6 atm
Ditanyakan: V2 = ?
Jawab:
P1 .V1/T1 = P2.V2 /T2
2 . 7/300 = 6 .V2 /315
300 . 6 . V2 = 2 . 7 . 315
1800V2 = 4410
V2 = 4410/1800
V2 = 2,45 L
Jadi, volume gas sekarang adalah 2,45 L.
Nah demikian materi tentang persamaan gas ideal (hukum Boyle - Gay Lussac), jika ada permasalahan atau kendala dalam memahami materi ini, silahkan tanyakan pada kolom kometar. Kita pasti bisa.








Tidak ada komentar :
Posting Komentar